Con la hipótesis de Einstein-Planck, el debate acerca de la naturaleza de la luz recobró todo el interés y lo hizo en medio de una física de nuevo en crisis. La crisis era propiciada en parte por estos hallazgos, dado que en el marco de la física clásica el modelo ondulatorio (según el cual consiste en la propagación del campo electromagnético) y el modelo corpuscular de la luz (según el cual está constituida por fotones) son incompatibles. Y, sin embargo existía una conciencia clara de que algo o mucho de ambos se debía de mantener, puesto que, como hemos visto, el modelo ondulatorio de Maxwell interpretaba satisfactoriamente una gran cantidad de fenómenos del comportamiento luminoso (reflexión, refracción, descomposición en colores, difracción, interferencias, efecto Doppler, polarización,..) y el modelo corpuscular resultaba necesario para interpretar un número creciente de nuevos hechos como el efecto fotoeléctrico, el efecto Compton, la radiación del cuerpo negro,.. | |||
En 1924 se produjo un avance fundamental que posibilitó una integración de las dos teorías en un modelo coherente e impulsó el desarrollo de la nueva física cuántica. El físico francés De Broglie (1892-1987), tras una larga meditación sobre la estructura de las grandes teorías físicas y obsesionado por el problema de los cuantos, tuvo la intuición de que el doble aspecto corpuscular y ondulatorio de la luz descubierto por Einstein debería reflejar una ley general de la naturaleza, extensible a todas las partículas materiales. En su tesis doctoral planteó una hipótesis mediante la que atribuyó a toda partícula con impulso, p (para una partícula de masa, m, y velocidad, v, p=m·v), una onda asociada, cuya longitud de onda es l = h/p (h es la constante de Planck). Por esta aportación De Broglie obtuvo el Premio Nobel de Física en 1929.
La incipiente física cuántica generalizó poco después esta hipótesis para considerar que toda entidad física individual (las partículas y también los fotones) tiene una naturaleza dual, lo que significa que su comportamiento global presenta dos aspectos complementarios: ondulatorio y corpuscular.
| |||
| |||
También dos haces de electrones pueden producir interferencias y así se comprueba en un experimento consistente en hacerlos pasar a través de una rendija doble o múltiple. La rendija, en este caso, puede ser una red iónica en la que la distancia entre cada dos núcleos positivos es del orden de magnitud de la longitud de onda que tienen los electrones a las velocidades típicas que portan en estos experimentos. Las interferencias se producen aunque los electrones se lancen de uno en uno hacia las rendijas, lo cual indica que el resultado observado en la pantalla no es fruto de un proceso estadístico producido por la incidencia de un número elevado de electrones, sino que cada electrón interfiere consigo mismo.
|
martes, 19 de noviembre de 2013
Naturaleza Dual De La Luz
espectro electromagnético
El espectro electromagnético (o simplemente espectro) es el rango de todas las radiaciones electromagnéticas posibles. El espectro de un objeto es la distribución característica de la radiación electromagnética de ese objeto.
El espectro electromagnético se extiende desde las bajas frecuencias usadas para la radio moderna (extremo de la onda larga) hasta los rayos gamma (extremo de la onda corta), que cubren longitudes de onda de entre miles de kilómetros y la fracción del tamaño de un átomo. Se piensa que el límite de la longitud de onda corta está en las cercanías de la longitud Planck, mientras que el límite de la longitud de onda larga es el tamaño del universo mismo, aunque en principio el espectro sea infinito y continuo.
Rango del espectro
El espectro cubre la energía de ondas electromagnéticas que tienen longitudes de onda diferentes. Las frecuencias de 30 Hz y más bajas pueden ser producidas por ciertas nebulosas estelares y son importantes para su estudio. Se han descubierto frecuencias tan altas como 2.9 * 1027 Hz a partir de fuentes astrofísicas.
La energía electromagnética en una longitud de onda particular λ (en el vacío) tiene una frecuencia asociada f y una energía fotónica E. Así, el espectro electromagnético puede expresarse en términos de cualquiera de estas tres variables, que están relacionadas mediante ecuaciones.
De este modo, las ondas electromagnéticas de alta frecuencia tienen una longitud de onda corta y energía alta; las ondas de frecuencia baja tienen una longitud de onda larga y energía baja.
Siempre que las ondas de luz (y otras ondas electromagnéticas) se encuentran en un medio (materia), su longitud de onda se reduce. Las longitudes de onda de la radiación electromagnética, sin importar el medio por el que viajen, son, por lo general, citadas en términos de longitud de onda en el vacío, aunque no siempre se declara explícitamente.
Generalmente, la radiación electromagnética se clasifica por la longitud de onda: ondas de radio, microondas, infrarroja y región visible, que percibimos como luz, rayos ultravioleta, rayos X y rayos gamma.
El comportamiento de la radiación electromagnética depende de su longitud de onda. Las frecuencias más altas tienen longitudes de onda más cortas, y las frecuencias inferiores tienen longitudes de onda más largas. Cuando la radiación electromagnética interacciona con átomos y moléculas, su comportamiento también depende de la cantidad de energía por cuanto que transporta. La radiación electromagnética puede dividirse en octavas (como las ondas sonoras).
La espectroscopia puede descubrir una región mucho más amplia del espectro que el rango visible de 400 nm a 700 nm. Un espectroscopio de laboratorio común puede descubrir longitudes de onda desde 2 nm a 2500 nm. Con este tipo de aparatos puede obtenerse información detallada sobre las propiedades físicas de objetos, gases o incluso estrellas. La espectrometría se usa sobre todo en astrofísica. Por ejemplo, muchos átomos de hidrógeno emiten ondas de radio que tienen una longitud de onda de 21.12 cm.
Tipos de radiación
Aunque el esquema de clasificación suele ser preciso, en realidad existe algo de trasposición entre tipos vecinos de energía electromagnética. Por ejemplo, las ondas de radio a 60 Hz pueden ser recibidas y estudiadas por astrónomos, o pueden ser conducidas a lo largo de cables como energía eléctrica. También, algunos rayos gamma de baja energía realmente tienen una longitud de onda más larga que algunos rayos X de gran energía. Esto es posible porque "rayo gamma" es el nombre que se le da a los fotones generados en la descomposición nuclear u otros procesos nucleares y subnucleares, mientras que los rayos X son generados por transiciones electrónicas que implican electrones interiores muy energéticos. Por lo tanto, la diferencia entre rayo gamma y rayo X está relacionada con la fuente de radiación más que con la longitud de onda de la radiación. Generalmente, las transiciones nucleares son mucho más energéticas que las transiciones electrónicas, así que los rayos gamma suelen ser más energéticos que los rayos X. Sin embargo, hay transiciones nucleares de baja energía (p.ej. la transición nuclear de 14.4 keV del Fe-57) que producen rayos gamma que son menos energéticos que algunos de los rayos X de mayor energía.
Radiofrecuencia
Las ondas de radio suelen ser utilizadas mediante antenas del tamaño apropiado (según el principio de resonancia), con longitudes de onda en los límites de cientos de metros a aproximadamente un milímetro. Se usan para la transmisión de datos, a través de la modulación. La televisión, los teléfonos móviles, las resonancias magnéticas, o las redes inalámbricas y de radio-aficionados, son algunos usos populares de las ondas de radio.
Las ondas de radio pueden transportar información variando la combinación de amplitud, frecuencia y fase de la onda dentro de una banda de frecuencia. El uso del espectro de radio está regulado por muchos gobiernos mediante la asignación de frecuencias. Cuando la radiación electromagnética impacta sobre un conductor, se empareja con él y viaja a lo largo del mismo, induciendo una corriente eléctrica en la superficie de ese conductor mediante la excitación de los electrones del material de conducción. Este efecto (el efecto piel) se usado en las antenas. La radiación electromagnética también puede hacer que ciertas moléculas absorban energía y se calienten, una característica que se utiliza en en los microondas.
Microondas
La frecuencia super alta (SHF) y la frecuencia extremadamente alta (EHF) de las microondas son las siguientes en la escala de frecuencia. Las microondas son ondas los suficientemente cortas como para emplear guías de ondas metálicas tubulares de diámetro razonable. La energía de microondas se produce con tubos klistrón y tubos magnetrón, y con diodos de estado sólido como los dispositivos Gunn e IMPATT. Las microondas son absorbidas por la moléculas que tienen un momento dipolar en líquidos. En un horno microondas, este efecto se usa para calentar la comida. La radiación de microondas de baja intensidad se utiliza en Wi-Fi.
El horno microondas promedio, cuando está activo, está en un rango cercano y bastante poderoso como para causar interferencia con campos electromagnéticos mal protegidos, como los que se encuentran en dispositivos médicos móviles y aparatos electrónicos baratos.
Rayos T
La radiación de terahertzios (o Rayos T) es una región del espectro situada entre el infrarrojo lejano y las microondas. Hasta hace poco, este rango estaba muy poco estudiado, ya que apenas había fuentes para la energía microondas en el extremo alto de la banda (ondas submilimétrica o también llamadas ondas terahertzios). Sin embargo, están apareciendo aplicaciones para mostrar imágenes y comunicaciones. Los científicos también buscan aplicar la tecnología de rayos T en las fuerzas armadas, donde podrían usarse para dirigirlas a las tropas enemigas, ya que las ondas de alta frecuencia incapacitan los equipos electrónicos.
Radiación infrarroja
La parte infrarroja del espectro electromagnético cubre el rango desde aproximadamente los 300 GHz (1 mm) hasta los 400 THz (750 nm). Puede ser dividida en tres partes:
* Infrarrojo lejano, desde 300 GHz (1 mm) hasta 30 THz (10 μm). La parte inferior de este rango también puede llamarse microondas. Esta radiación es absorbida por los llamados modos rotatorios en las moléculas en fase gaseosa, mediante movimientos moleculares en los líquidos, y mediante fotones en los sólidos. El agua en la atmósfera de la Tierra absorbe tan fuertemente esta radiación que confiere a la atmósfera efectividad opaca. Sin embargo, hay ciertos rangos de longitudes de onda ("ventanas") dentro del rango opaca¡o que permiten la transmisión parcial, y pueden ser usados en astronomía. El rango de longitud de onda de aproximadamente 200 μm hasta unos pocos mm suele llamarse "radiación submilimétrica" en astronomía, reservando el infrarrojo lejano para longitudes de onda por debajo de los 200 μm.
* Infrarrojo medio, desde 30 a 120 THz (10 a 2.5 μm). Los objetos calientes (radiadores de cuerpo negro) pueden irradiar fuertemente en este rango. Se absorbe por vibraciones moleculares, es decir, cuando los diferentes átomos en una molécula vibran alrededor de sus posiciones de equilibrio. Este rango es llamado, a veces, región de huella digital, ya que el espectro de absorción del infrarrojo medio de cada compuesto es muy específico.
* Infrarrojo cercano, desde 120 a 400 THz (2500 a 750 nm). Los procesos físicos que son relevantes para este rango son similares a los de la luz visible.
Radiación visible (luz)
La frecuencia por encima del infrarrojo es la de la luz visible. Este es el rango en el que el Sol y las estrellas similares a él emiten la mayor parte de su radiación. No es probablemente una coincidencia que el ojo humano sea sensible a las longitudes de onda que el sol emite con más fuerza. La luz visible (y la luz cercana al infrarrojo) son absorbidas y emitidas por electrones en las moléculas y átomos que se mueven desde un nivel de energía a otro. La luz que vemos con nuestros ojos es realmente una parte muy pequeña del espectro electromagnético. Un arco iris muestra la parte óptica (visible) del espectro electromagnético; el infrarrojo (si pudiera verse) estaría localizado justo a continuación del lado rojo del arco iris, mientras que el ultravioleta estaría tras el violeta.
La radiación electromagnética con una longitud de onda entre aproximadamente 400 nm y 700 nm es detectado por el ojo humano y percibida como luz visible. A otras longitudes de onda, sobre todo al infrarrojo cercano (más largo de 700 nm) y al ultravioleta (más corto que 400 nm) también se les llama luz a veces, sobre todo cuando la visibilidad para los humanos no es relevante.
Si la radiación que tiene una frecuencia en la región visible del espectro electromagnético se refleja en un objeto, como por ejemplo un plato hondo de fruta, y luego impacta en nuestros ojos, obtenemos una percepción visual de la escena. El sistema visual de nuestro cerebro procesa la multitud de frecuencias reflejadas en diferentes sombras y matices, y a través de este fenéomeno psicofísico que todavía no se entiende completamente, es como percibiríamos los objetos.
En la mayor parte de las longitudes de onda, sin embargo, la información transportada por la radiación electromagnética no es directamente descubierta por los sentidos humanos. Las fuentes naturales producen radiación electromagnética a través del espectro, y nuestra tecnología también puede manipular un amplio rango de longitudes de onda. La fibra óptica transmite luz que, aunque no es adecuada para la visión directa, puede transportar datos que luego son traducidos en sonido o imagen. La codificación usada en tales datos es similar a lo que se usa con las ondas de radio.
Luz ultravioleta
La siguiente frecuencia en el espectro es el ultravioleta (o rayos UV), que es la radiación cuya longitud de onda es más corta que el extremo violeta del espectro visible.
Al ser muy energética, la radiación ultravioleta puede romper enlaces químicos, haciendo a las moléculas excepcionalmente reactivas o ionizándolas, lo que cambia su comportamiento. Las quemaduras solares, por ejemplo, están causadas por los efectos perjudiciales de la radiación UV en las células de la piel, y pueden causar incluso cáncer de piel si la radiación daña las moléculas de ADN complejas en las células (la radiación UV es un mutágeno). El Sol emite una gran cantidad de radiación UV, lo que podría convertir rápidamente la Tierra en un desierto estéril si no fuera porque, en su mayor parte, es absorbida por la capa de ozono de la atmósfera antes de alcanzar la superficie.
Rayos X
Después del ultravioleta vienen los rayos X. Los rayos X duros tienen longitudes de onda más cortas que los rayos X suaves. Se usan generalmente para ver a través de algunos objetos, así como para la física de alta energía y la astronomía. Las estrellas de neutrones y los discos de acreción alrededor de los agujeros negros emiten rayos X, lo que nos permite estudiarlos.
Los rayos X pasan por la mayor parte de sustancias, y esto los hace útiles en medicina e industria. También son emitidos por las estrellas, y especialmente por algunos tipos de nebulosas. Un aparato de radiografía funciona disparando un haz de electrones sobre un "objetivo". Si los electrones se disparan con suficiente energía, se producen rayos X.
Rayos gamma
Después de los rayos X duros vienen los rayos gamma. Son los fotones más energéticos, y no se conoce el límite más bajo de su longitud de onda. Son útiles a los astrónomos en el estudio de objetos o regiones de alta energía, y son útiles para los físicos gracias a su capacidad penetrante y su producción de radioisótopos. La longitud de onda de los rayos gamma puede medirse con gran exactitud por medio de dispersión Compton.
No hay ningún límite exactamente definido entre las bandas del espectro electromagnético. Algunos tipos de radiación tienen una mezcla de las propiedades de radiaciones que se encuentran en las dos regiones del espectro. Por ejemplo, la luz roja se parece a la radiación infrarroja en que puede resonar algunos enlaces químicos.
teoria cuántica de planck
En 1900 emitió una hipótesis que interpretaba los resultados experimentales satisfactoriamente como los cuerpos captaban o emitían energía. Según Planck, la energía emitida o captada por un cuerpo en forma de radiación electromagnética es siempre un múltiplo de la constante h, llamada posteriormente constante de Planck por la frecuencia v de la radiación y ha esta energia la llama quantom
En otras palabras más sencillas: La ley de Planck establece que la energía de cada cuanto es igual a la frecuencia de la radiación multiplicada por la constante universal. Sus descubrimientos, sin embargo, no invalidaron la teoría de que la radiación se propagaba por ondas. Los físicos en la actualidad creen que la radiación electromagnética combina las propiedades de las ondas y de las partículas.
Es decir, es la constante de la relación de proporcinalidad entre energía y frecuencia.
Teoria CUANTICA DE PLANK, veamos en un aspecto practico
Cuando un cuerpo es calentado emite radiación electromagnética en un amplio rango de frecuencias.
El cuerpo ***** (ideal) es aquel que además absorbe toda la radiación que llega a él sin reflejarla, de tal forma que sólo emite la correspondiente a su temperatura.
A fines del siglo XIX fue posible medir la radiación de un cuerpo ***** con mucha precisión. La intensidad de esta radiación puede en principio ser calculada utilizando las leyes del electromagnetismo. El problema de principios del siglo ** consistía en que si bien el espectro teórico y los resultados experimentales coincidían para bajas frecuencias (infrarrojo), estos diferían radicalmente a altas frecuencias. Este problema era conocido con el provocativo nombre de “la catástrofe ultravioleta”, ya que la predicción teórica diverge a infinito en ese límite.
-Esto es no concordaba la frecuencia emitida con la temperatura de acuerdo a la proporcinalidad entfuera de ciertos limites haciendose la discordancia catástrofica!
Quien logró explicar este fenómeno fue Max Planck, en 1900, que debió para ello sacrificar los conceptos básicos de la concepción ondulatoria de la radiación electromagnética.
Para resolver la catástrofe era necesario aceptar que la radiación no es emitida de manera continua sino en cuantos de energía discreta, a los que llamamos fotones.
La energía de estos fotones es:
E (fotón) = h.ν
ν : Frecuencia de la radiación electromagnética (s-1)
h : constante de Planck
h = 6,62.10-27 erg.s
h = 6,62.10-34 J.s
Cuando la frecuencia de la radiación es baja el efecto de la discretización se vuelve despreciable debido al minúsculo valor de la constante de Planck, y es perfectamente posible pensar al sistema como continuo, tal como lo hace el electromagnetismo clásico. Sin embargo, a frecuencias altas el efecto se vuelve notable.
El propio Planck nunca avanzó una interpretación significativa de sus quantums. En 1905 Einstein, basándose en el trabajo de Planck, publicó su teoría sobre el fenómeno conocido como efecto fotoeléctrico. Dados los cálculos de Planck, Einstein demostró que las partículas cargadas absorbían y emitían energías en cuantos finitos que eran proporcionales a la frecuencia de la luz o radiación. En 1930, los principios cuánticos formarían los fundamentos de la nueva física.
En otras palabras más sencillas: La ley de Planck establece que la energía de cada cuanto es igual a la frecuencia de la radiación multiplicada por la constante universal. Sus descubrimientos, sin embargo, no invalidaron la teoría de que la radiación se propagaba por ondas. Los físicos en la actualidad creen que la radiación electromagnética combina las propiedades de las ondas y de las partículas.
Es decir, es la constante de la relación de proporcinalidad entre energía y frecuencia.
Teoria CUANTICA DE PLANK, veamos en un aspecto practico
Cuando un cuerpo es calentado emite radiación electromagnética en un amplio rango de frecuencias.
El cuerpo ***** (ideal) es aquel que además absorbe toda la radiación que llega a él sin reflejarla, de tal forma que sólo emite la correspondiente a su temperatura.
A fines del siglo XIX fue posible medir la radiación de un cuerpo ***** con mucha precisión. La intensidad de esta radiación puede en principio ser calculada utilizando las leyes del electromagnetismo. El problema de principios del siglo ** consistía en que si bien el espectro teórico y los resultados experimentales coincidían para bajas frecuencias (infrarrojo), estos diferían radicalmente a altas frecuencias. Este problema era conocido con el provocativo nombre de “la catástrofe ultravioleta”, ya que la predicción teórica diverge a infinito en ese límite.
-Esto es no concordaba la frecuencia emitida con la temperatura de acuerdo a la proporcinalidad entfuera de ciertos limites haciendose la discordancia catástrofica!
Quien logró explicar este fenómeno fue Max Planck, en 1900, que debió para ello sacrificar los conceptos básicos de la concepción ondulatoria de la radiación electromagnética.
Para resolver la catástrofe era necesario aceptar que la radiación no es emitida de manera continua sino en cuantos de energía discreta, a los que llamamos fotones.
La energía de estos fotones es:
E (fotón) = h.ν
ν : Frecuencia de la radiación electromagnética (s-1)
h : constante de Planck
h = 6,62.10-27 erg.s
h = 6,62.10-34 J.s
Cuando la frecuencia de la radiación es baja el efecto de la discretización se vuelve despreciable debido al minúsculo valor de la constante de Planck, y es perfectamente posible pensar al sistema como continuo, tal como lo hace el electromagnetismo clásico. Sin embargo, a frecuencias altas el efecto se vuelve notable.
El propio Planck nunca avanzó una interpretación significativa de sus quantums. En 1905 Einstein, basándose en el trabajo de Planck, publicó su teoría sobre el fenómeno conocido como efecto fotoeléctrico. Dados los cálculos de Planck, Einstein demostró que las partículas cargadas absorbían y emitían energías en cuantos finitos que eran proporcionales a la frecuencia de la luz o radiación. En 1930, los principios cuánticos formarían los fundamentos de la nueva física.
Modelo atómico de Sommerfeld
El físico alemán Arnold Sommerfeld, crea en 1916, el modelo atómico que lleva su nombre, para dar algunas mejoras al modelo atómico de Bohr, ayudándose de la relatividad deAlbert Einstein, teoría que había conocido al entrar como profesor en la Universidad de Munich, cuando aun la teoría de la relatividad no estaba aceptada. Sommerfeld, es más conocido en el mundo científico por su aportación a la ciencia con la constante de la estructura fina en 1919, que es la constante física fundamental en la interacción electromagnética.
El modelo atómico de Bohr, tenía algunas insuficiencias, ya que aunque funcionaba perfectamente para el átomo de hidrógeno, no funcionaba de igual manera para dar explicación a los espectros realizados para otros átomos de otros elementos, donde se veía claramente que los electrones de un mismo nivel energético poseían diferentes energías. Lo cual hacía evidente, que algo faltaba en ese modelo.
Sommerfeld, llegó a la conclusión, de que este comportamiento de los electrones se podía explicar, diciendo que dentro de un mismo nivel de energía existían distintos subniveles energéticos, lo que hacía que hubiesen diversas variaciones de energía, dentro de un mismo nivel teóricamente, Sommerfeld había encontrado que en algunos átomos, las velocidades que experimentaban los electrones llegaban a ser cercanas a la de la luz, así que se dedicó a estudiar los electrones como relativistas.
Fue en 1916 cuando Sommerfeld perfeccionó el modelo atómico de Bohr, intentando solucionar los dos defectos principales de ese modelo. De este modo, hizo dos básicas modificaciones:
- Los electrones describían órbitas cuasi- elípticas.
- Velocidades relativistas.
Según Bohr, os electrones giraban exclusivamente en modo circular. Una orbita céntrica dio lugar a un nuevo número cuántico, que se denominaría como número cuántico Azimutal, que definiría la forma de los orbitales, y se representaría con la letra l, tomando valores variables desde 0 hasta n-1.
Así, las órbitas con:
- l=0 serían los posteriormente conocidos como orbitales S.
- l=1 se llamaría orbital 2p u orbital principal.
- l=2 se conocería como d, u orbital diffuse.
- L=3 sería el orbital llamado f o fundamental.
Sommerfeld defendió, que el núcleo de los átomos no es permanece quieto, sino que ya sea electrón o núcleo, ambos realizan un movimiento entorno al centro de masas del sistema, que se encontrará cercano al núcleo debido a que posee una masa miles de veces mayor que la masa del electrón. Esto hacía coincidir las frecuencias calculadas con las experimentadas.
Las líneas espectrales se desdoblaban y para explicar este punto, Sommerfeld, usando buenos espectroscopios, supuso que los electrones podían tener orbitas tanto elípticas como circulares. Añade el número cuántico secundario ( l) e indica en la orbita del electrón, el momento angular de éste como,  hallando los subniveles de energía para cada nivel cuántico.
hallando los subniveles de energía para cada nivel cuántico.
El modelo atómico de Sommerfeld, es una adaptación mejorada y generalizada del modelo atómico de Bohr, dándole a éste, un punto de vista relativista, pero aun así, no pudo explicar los modos de emisión que tenían las órbitas elípticas, pudiendo sólo descartar las órbitacirculares.
Modelo Mecanico Cuantico
Es el actual modelo: este modelo se expuso por vez primera en 1925 por Schrodinger y Heisenberg.
Sus aspectos y características:
- Dualidad onda.partícula: la propuesta de Broglie; Todas las partículas materiales tienen propiedades ondulatorias y también que las partículas que están en movimiento lleva una onda asociada.
- Principio de Indeterminación: La afirmación de Heisenberg con relación a que era imposible situar a un electrón dado en un punto exacto del espacio.

El comportamiento de los electrones presentes en el átomo, esta representado por la ecuaciones del modelo mecanico-cuantico, dando la posibilidad de identificar su carácter ondulatorio y deja claro que es imposible predecir su recorrido exacto.
De esta manera se logro establecer un concepto de modelo orbital, para poder intuir un determinado sector o región en el espacio del átomo donde se podría encontrar un electrón siendo este espacio muy grande.
- Las características de los orbitales:
- La energía esta cuantizada.
- La diferencia entre el modelo de Bohr el cual determina su posición exacta del electrón, en cambio se presume una mayor o menor probabilidad de este en el espacio.
- Dentro del átomo, se da la interpretación que el electrón se puede aprecia como nube de carga negativa, y donde se encuentre mayor densidad dentro de la nube, aumenta la probabilidad de encontrar en ese espacio un electrón.
Formula: _18
E n=3= 2,18 X 10 =
Arquitectura Electronica
Algunas propiedades físicas y todas las propiedades químicas de los átomos, están determinadas por la corteza de los electrones,razón por la cual la importancia de conocer como están distribuidos los electrones en los átomos, esa manera como están distribuidos se le conoce como configuración electrónica del estado fundamental o basal de los átomos.
Condiciones Para La Realización De La Configuración Electrónica
Principio de Ordenamiento: Al ser ordenados los elementos de forma creciente de acuerdo a su número atómico en la tabla periódica, cada átomo de un elemento tendrá un electrón más que el del elemento que le precede. Ejemplo.: Nitrógeno (Z=7), Oxigeno ( Z=8).
Principio de Aufbau o Principio de Construcción: El electrón que precede aun electrón de un elemento posterior se ubica en el orbital atómico de menor energía disponible (s ó p).
Principio de Exclusión de Paule: Establece que no es posible que dos electrones tengan los mismos cuatro números cuánticos ( n, l, ml, ms ), es decir, un orbital no puede contener más de dos electrones y los espines de dichos electrones deben tener valores opuestos (↓↑).
Principio de Máxima Multiplicidad de Carga (regla de Hund): los electrones de un mismo subnivel se organizan de modo que exista el mayor número posible de electrones desapareados con el mismo valor del espín, es decir,primero se ocupa con un solo electrón con el mismo valor del espín los orbitales presentes, y después se complementan con electrones con espín opuesto al anterior colocado en el orbital; cuando un orbital contienen únicamente un electrón se dice que este está desapareado.
La ecuación de Schrödinger fue desarrollada por el fisico austriaco erwin schrodinger en 1925. Describe la evolución temporal de una partícula masiva no relativista. Es de importancia central en la teoría de la mecanica cuantica, donde representa para las partículas microscópicas un papel análogo a la segunda ley de newton en la mecanica clasica. Las partículas microscópicas incluyen a las partículas elementales, tales como electrones, así como sistemas de partículas, tales como núcleos atómicos.
los numeros cuanticos
Los números cuánticos son unos números que se conservan en los sistemas cuánticos. Corresponden con aquellos observables que conmutan con el hamiltoniano del sistema. Así, los números cuánticos permiten caracterizar los estados estacionerios, es decir los estados propios del sistema.
En fisica de particulas, también se emplea el término números cuánticos para designar a los posibles valores de ciertos observables o magnitud fisica que poseen un espectro o rango posible de valore
configuraciones electronicas
Al referirnos a la configuración electrónica (o periódica) estamos hablando de la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.
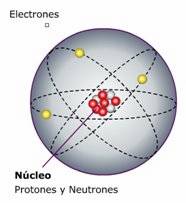 |
| Modelo atómico general. |
Configurar significa "ordenar" o "acomodar", y electrónico deriva de "electrón"; así, configuración electrónica es la manera ordenada de repartir los electrones en los niveles y subniveles de energía.
Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.
Debemos acotar que aunque el modelo de Schrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
Para comprender (visualizar o graficar) el mapa de configuración electrónica (o periódica) es necesario revisar los siguientes conceptos.
Los Números Cuánticos
En el contexto de la mecánica cuántica, en la descripción de un átomo se sustituye el concepto de órbita por el de orbital atómico. Un orbital atómico es la región del espacio alrededor del núcleo en el que la probabilidad de encontrar un electrón es máxima.
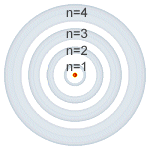 |
| Número cuántico principal (n). |
La solución matemática de la ecuación de Schrödinger precisa de tres números cuánticos. Cada trío de valores de estos números describe un orbital.
Número cuántico principal (n): puede tomar valores enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico introducido por Bohr. Está relacionado con la distancia promedio del electrón al núcleo en un determinado orbital y, por tanto, con el tamaño de este e indica el nivel de energía.
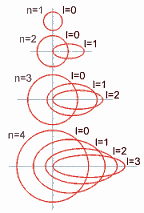
Número cuántico secundario (l): Los niveles de energía, identificados con el número cuántico principal (n), poseen subniveles, los cuales se asocian, además, a la forma del orbital, y son identificados por el número cuántico secundario (l). Entonces, los valores del número cuántico secundario dependen del número cuántico principal "n".
Así, la cantidad de subniveles de energía que posea cada nivel principal está dada por la fórmula n – 1 (el valor del número cuántico principal menos uno).
Este número cuántico secundario (l) nos indica en que subnivel se encuentra el electrón, y toma valores desde 0 hasta (n - 1), recordando que n es el valor del número cuántico principal. Así, para cada nivel n, el número cuántico secundario (l) será:
l = 0, 1, 2, 3,…, n-1.
Ejemplo:
Si n = 1 (n – 1 = 0), entonces l = 0 (en el nivel de energía 1 no hay subniveles de energía, y para efectos de comprensión se considera este nivel 1 como subnivel 0)
Si n = 2 (n -1 = 1), entonces l = 0, 1. El nivel de energía 2 posee dos subniveles, identificados como 0 y 1
Si n = 3 (n – 1 = 2), entonces l = 0, 1, 2. El nivel de energía 3 posee tres subniveles, identificados como 0, 1 y 2
Si n = 4 (n – 1 = 3), entonces l = 0, 1, 2, 3. El nivel de energía 4 posee cuatro subnoiveles, identificados como 0, 1, 2 y 3
Si n = 5 (n – 1 = 4), entonces l = 0, 1, 2, 3, 4. El nivel de energía 5 posee cinco subnoveles, identificados como 0, 1, 2, 3 y 4
También para efectos de comprensión, la comunidad científica ha aceptado que los números que representan los subniveles (0, 1, 2, y 3) sean reemplazados por las letras s, p, d y f, respectivamente, para representar los distintos tipos de orbitales.
Estas letras se optiene de la inicial de las palabras sharp (s), principal (p), difuso (d) y fundamental (f).
Cada subnivel, a su vez, posee distinta cantidad de orbitales, lo cual veremos más adelante.
Ahora, con respecto a la forma del orbital de estos subniveles, el número cuántico secundario (o azimutal) determina laexcentricidad de la órbita: cuanto mayor sea este número, más excéntrica será la órbita; es decir, será más aplanada la elipse que recorre el electrón.
Así, en el nivel 1 (o capa K) el valor del nivel (identificado como subnivel 0) es cero (no hay excentricidad) y su órbita es circular.
Cada vez que aumenta el valor del número cuántico secundario (o azimutal) aumenta la excentricidad de la órbita, como se demuestra en el siguiente gráfico:
 |
Suscribirse a:
Entradas (Atom)




